1 引 言
超声造影剂(ultrasound contrast agent, UCA)是一类能够显著增强医学超声检测信号的诊断药剂,在人体微小血管和组织灌注检测与成像方面,使用UCA 进行超声检测具有成像效果好、实时、操作简便、无离子辐射、无损性、适用面广等优点,因此在医学临床检测中得到了越来越多的应用[1~3] 。超声成像基于回波信号的反射强度,微泡具有较强的回波反射性 能,目前被认为是最好的人体微管内的造影材料。以微泡制成的超声造影剂称为微泡型超声造影剂 (microbble ultrasound contrast agents, mUCA),现在 作为声学造影剂应用的一般均是微泡型的造影剂,因此微泡型超声造影剂可简化称为 UCA。
UCA 的出现,开创了无创伤超声医学的一个崭新的领域,除了作为超声诊断药剂之外,近年来还发现 UCA 具有分子成像、促进血栓溶解、促进基因转染及药物体内运输定点释放等作用[4~7],这使得 UCA也成为目前医学领域的一个研究热点。
近几年来,国外 UCA 的制备及其应用研究十分活跃,而国内 UCA 的制备研究基本以声空化人血清白蛋白为主,其研究及应用基本停留于国外上个世纪90年代初的水平,并且国内目前还没有 UCA 的生产厂家,而国外生产的各种 UCA 都过于昂贵, 一瓶一百多美元的 UCA 只能用于一次超声造影。越来越多的研究显示,UCA 目前已成为医学超声检测上必不可少的诊断药剂,UCA 在其它医学领域还显示着许多诱人的应用前景,因此在我国研究开发 UCA 的制 备技术具有巨大的研究和实际应用价值。
UCA 的发展经历了早期的以实验用生理盐水、染料、胶体、乳液和含有自由气泡的液体为代表的第一代声学造影剂,以包裹室内空气的人血清白蛋白微泡为代表的第二代声学造影剂。1993 年由于新的发现,微泡的气体材料得到了重视,1995 年后,出现了以全氟化碳等高分子量气体作为微泡内的填充气体,自此形成了第三代稳定微泡超声造影剂。目前,UCA 正在向具备有靶向诊断(包括分子成像)、靶向载药的第四代 功能性声学造影剂方面发展。
2 微泡造影剂的包膜材料
1972 年 Ziskin[8]发现造影效果是由液体中的气体形成的气泡导致的,因此他认为造影效果是由所选液体的物理化学性质决定的,当然这一结论目前看来并不完全正确。受 Ziskin 的影响,人们后来开始尝试采用各种液体介质作为微气泡的膜,如生理盐水、右旋 糖苷、山梨醇、胶体溶液、人血清白蛋白等。
目前, 已有多种材料被用来作为微泡的膜,这里我们将其分类介绍如下,同时按照主要膜材料的不同分别介绍目前最新研究和应用的微泡超声造影剂。
2.1 表面活性剂类
由于表面活性剂本身的特性,目前已制备出的超声造影剂中大都或多或少含有一些表面活性剂成份, 如 AF0150 中就含有少量的表面活性剂,AF0150 是 美国 Alliance 制药公司生产的微泡超声造影剂,AF0150 是采用干燥方法制成的粉体,粉体其中含有 表面活性剂、盐、缓冲物质,粉体以全氟化碳气体饱和并储存在密闭小瓶中,使用时注入无菌水就会形成微泡,微泡平均尺寸 5μm,浓度 5×108 个/ml[9]。目前的 ST 系列造影剂的膜材料是基于表面活性剂的, 这里,S 指的是 Span 类表面活性剂,T 指的是 Tween 类,Span 类和 Tween 类均为非离子表面活性剂。ST 系列中常见的是 ST44 和 ST68,ST44 采用 Tween40 和 Span60,ST68 采用 Span60 and Tween80,微泡中 的气体已采用的有空气、全氟丁烷和六氟化硫。大部 分基于表面活性剂微泡的制备方法可以采用声空化、 冷冻干燥、热气流干燥等。ST68 平均直径为 3.8μm, 浓度为 7.1×108 /ml, ST68 在 4~6 周内微泡浓度无明 显变化。Wheatley 等发现稳定的表面活性剂微泡组成中一般包含一种液态表面活性剂和一种固态表面活 性剂,此外,Span 类表面活性剂仅 Span40 和 Span60 能和 Tween 类除 Tween85 之外的其它 Tween 类表面 活性剂形成稳定微泡,从 HLB 值上来说,稳定微泡 的组成成分里需要含一种 HLB>10.5 的表面活性剂 和一种 HLB<9 的表面活性剂[10]。
2.2 蛋白质类
蛋白质类物质以人血清白蛋白用于超声造影剂 的研究及临床应用最多,制备方法采用声空化法,白 蛋白浓度取为 5%。在蛋白质中加入一些助剂,可以 显著提高蛋白质微泡的性能,文献[11]中介绍在蛋白质中加入蔗糖形成的气泡分散性好,而且在加热的情况 下也不破裂,基于这一结果,我们将其用于制备造影 剂微泡,通过在 5%人血清白蛋白中加入 40%蔗糖,并通入全氟丙烷气体,制得了十分稳定的白蛋白微泡[12]。 也有研究者在蛋白质中加入葡萄糖及右旋糖酐来改 善微泡性能。美国 Molecular Biosystems 公司生产的 Albunex 是最早上市的微泡超声造影剂,该公司近来 还开发出了 Optison 微泡造影剂,Optison 采用 1%人 血清白蛋白,包裹的气体是全氟丙烷[13]。Porter TR 和 Xie F 等开发的 PESDA 为声空化 50%右旋糖苷、 5%人血清白蛋白,微泡内气体为全氟化碳,据其报 道可以实现较好的心肌显影,PESDA 浓度为 5× 109 ~6×109 个/ml,平均直径 4.7±0.3μm[14]。
2.3 脂类物质
脂类物质尤其是脂质体作为 UCA 膜材料的研究 近年来也较多一些。脂类形成的 UCA 膜可以分为两种:一种膜中的脂质分子为单层排列;另一种膜中的脂质形成类似于细胞膜的双分子层结构。脂类 UCA 一般均较稳定,放置时间也较长。脂质体是当两亲分子如磷脂分子分散在水中时,能自发形成磷脂双分子 包裹溶液的球形封闭小囊泡,即为脂质体。脂质体的粒径一般在几十个纳米到几个微米之间。以脂质体通过化学修饰可以制成具有靶向功能的微泡造影剂,在特定的器官部位聚集,实现对该部位的最佳造影效果。一般来说,饱和脂质体作为微泡膜要比不饱和脂质体好一些,因为饱和脂质体在生理温度下以凝胶形 式存在而不饱和脂质体以液晶形式存在。凝胶状态的 脂质体内部烷基基团的排列要比液晶形式存在的脂 质体紧密得多,因此做成的膜使气体分子更难以渗透 通过。如二棕榈酰磷脂酰胆碱为一烷基上有 16 个碳 原子的饱和磷脂,其相变温度为 42℃,生理温度下 则以难被气体透过的凝胶形式存在[15,16]。德国 ByK Gulden 公司开发的 BY963 以 3-磷脂酰-甘油基-二硬 脂酰的钠盐为膜材料,该材料类似于生物细胞膜的基本成分,即含硬脂酸的饱和磷脂。
2.4 聚合物
聚合物作为微泡 UCA 的膜材料是因为分子间的 作用力较强,从而使膜的稳定性较高。聚合物一般需要通过交联的方法来制备微泡液膜,在 UCA 中已采 用的高分子材料有聚乙二醇 4000、聚丁基-2-氰基丙 烯酸酯、多聚糖、海藻酸盐等。聚合物膜可以做得非 常薄,如以聚丁基-2-氰基丙烯酸酯为微泡膜时的厚度 接近 100nm,而且膜的弹性好,形成的微泡非常稳定, 能够忍受巨噬细胞的吞噬,从而实现淋巴等部位的被 动靶向造影[17]。瑞士 Bracco Research 公司采用冻干法制备出聚乙二醇的空心干粉,再与六氟化硫混合物 密封保存,开发出了 BR1 微泡超声造影剂,该造影 剂使用时同其它干粉剂一样,需加入无菌水,即得到 微泡。Sonus 公司生产的气液相变型造影剂 Echogen, 采用了表面活性剂微乳化非离子聚合物和 2.2%全氟 戊烷异构体混合物,乳化液滴的直径为 0.2μm,在 29℃下,全氟戊烷由液体转变为气体,形成的微泡的 体积较原来液滴增大 2.8 倍,在生理温度下,微泡直 径进一步增大达到 2~3μm,成为超声波的强反射体。
2.5 糖类物质
基于糖类物质的微泡超声造影剂一般均具有很好的安全性和生物相容性。多聚糖如淀粉可被加入到一些配方中用来提高微泡的稳定性,因为加入淀粉可 以增强微泡膜分子之间的作用力。单糖和寡聚糖分子较小,相互作用力不强,形成微泡的方法不同于淀粉 等多聚糖,单糖和寡聚糖用来制备微泡时采用了气泡形成的基本物理原理[18]:在任何被气体过饱和的液体中,气泡首先在液体中的一些固体表面形成,如容器表面和分散在液体中的糖类物质的固体粉末位点,而 且形成的气泡可以存在很长时间。采用这一原理制备 出的微泡尺寸分布集中,微泡也有足够的存在时间。 德国 Schering AG 公司开发出了两种基于半乳糖的微 泡超声造影剂 Echovist 和 Levovist, 这两种造影剂均 是首先通过干燥的方法制成粉末,使用时将定量的粉 末与水溶液混合,然后剧烈摇动数秒钟,这些粉末会首先会分散成更小的微粒,这些微粒则会成为微泡形 成的位点,最后形成了的溶液每 ml 含有 200~400 mg 的微泡。微粒的尺寸决定了围绕其形成的微泡的尺寸,形成的微泡溶液约 2min 后达到平衡,随后可以 保持约 10min 的超声回波能力。Echovist 和 Levovist 化学组成基本相同,只是 Levovist 成分中多了 0.1% 的棕榈酸,这一少量的棕榈酸显著增强了 Levovist 微泡的稳定性,使其可以通过肺循环而进入动脉循 环。这些造影剂静脉注射后,微泡附着的半乳糖微粒会溶解,微泡则继续存在,形成回波加强了的血流。
3 微泡超声造影剂及其造影效果
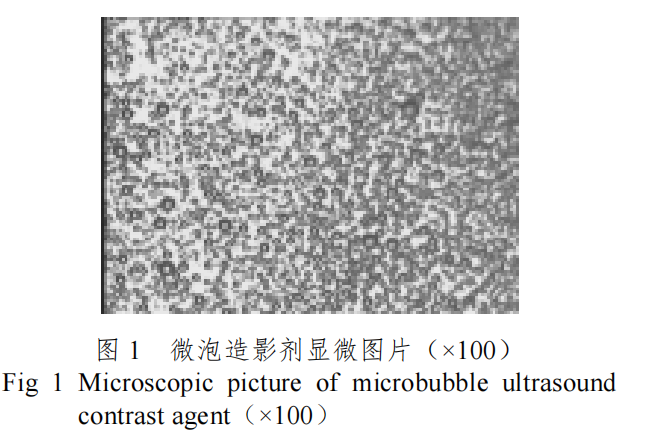
图 1 时我们采用表面活性剂及其助剂制备的微泡超声造影剂显微图片(×100),微泡平均直径 3.95μm, 微泡浓度 3.6x109 个/ml[19,20]。
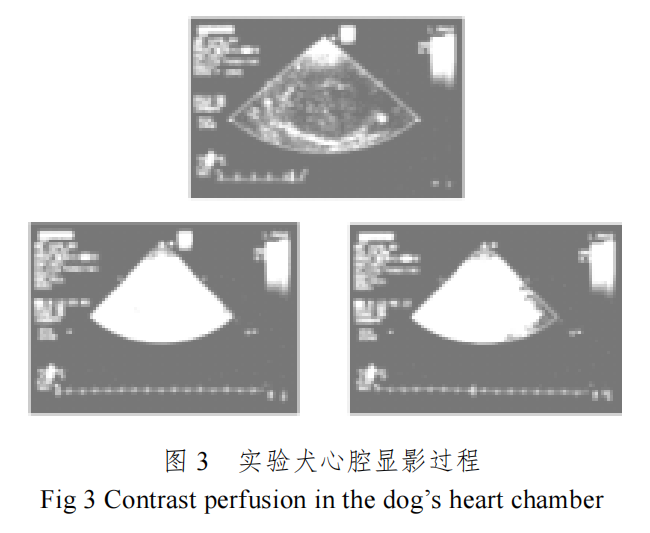
2 是我们采用图 1 所示的微泡造影剂进行的试 验犬肾脏血流灌注造影实验结果,
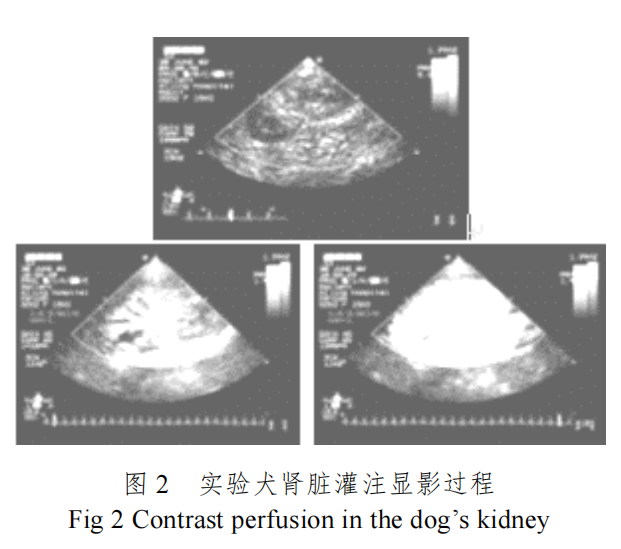
图 3 是试验犬心腔 造影实验结果,
从图 2 和图 3 可以清晰看出微泡超声造影剂的造影效果。
4 微泡超声造影剂与靶向制剂
利用靶向分子导向一直是非常活跃的一个研究领域,但由于目前对生物体本身各类生化作用的特异性还远缺乏了解,这对该方法的应用产生了一个目前仍然无法克服的瓶颈效应。采用在微米微泡及亚微米或纳米载药微球膜上分别引入能发生相互作用的分 子或基团,然后将微泡与微球载药体按一定比例连接,静脉注入体内后,在特定组织部位通过超声引爆微米微泡,利用微泡崩溃时产生的能量将周围连接的微球击碎,从而达到药物及微泡的靶向运输与控制释放的目的,这一过程可以同时实现造影与释药,即同时实现诊断与治疗的目的。由于不涉及体内的生化反应,而微泡与微球的连接很容易通过一些化学方法实 现如羧基与氨基之间的作用等,此外由于体外超声引爆微米微泡的无损性、安全性和可控性在微泡超声造影剂的应用中已得到广泛证实,因此认为这一方案可 能会成为今后较短时期内靶向给药及控制释放的突破点。除了可以在微泡表面接入载药微球之外,也可 在微泡制备时将药物包裹在微泡中,形成同时包裹药 物和气体的载药载气的微泡体,如果在内部包裹药物 的表面接入靶向分子,则可以实现微泡定向引爆和靶向分子导向的双重靶向作用。















