脂质体介绍资料
根据百度百科整理
参考来源:https://baike.baidu.com/item/脂质体/1720600?fr=aladdin
一、什么是脂质体?
脂质体(Liposomes)是由卵磷脂和神经酰胺等制得的脂质体(空心),具有的双分子层结构与皮肤细胞膜结构相同,对皮肤有优良的保湿作用,尤其是包敷了保湿物质如透明质酸、聚葡糖苷等的脂质体是更优秀的保湿性物质[1]。
脂质体(liposome)是一种人工膜。在水中磷脂分子亲水头部插入水中,脂质体疏水尾部伸向空气,搅动后形成双层脂分子的球形脂质体,直径25~1000nm不等。脂质体可用于转基因,或制备的药物,利用脂质体可以和细胞膜融合的特点,将药物送入细胞内部 生物学定义:当两性分子如磷脂和鞘脂分散于水相时,分子的疏水尾部倾向于聚集在一起,避开水相,而亲水头部暴露在水相,形成具有双分子层结构的的封闭囊泡,称为脂质体。药剂学定义 脂质体 (liposome): 系指将药物包封于类脂质双分子层内而形成的微型泡囊体。
脂质体的分类:
(1)脂质体按照所包含类脂质双分子层的层数不同,分为单室脂质体和多室脂质体。
小单室脂质体(SUV):粒径约0.02~0.08μm;大单室脂质体 (LUV)为单层大泡囊,粒径在0.1~lμm。
多层双分子层的泡囊称为多室脂质体 (MIV),粒径在1~5μm之间。
(2)按照结构分:单室脂质体,多室脂质体,多囊脂质体
(3)按照电荷分:中性脂质体,负电荷脂质体,正电荷脂质体
(4)按照性能分:一般脂质体,特殊功效脂质体
脂质体的制备:
脂质体制备方法多样,常规制备方法如下:
(1)MLV(multilamellar vesicle):Vortex-mixing(涡旋式混合)
(2)SMV(small multilamellar vesicle):Ultrasonication(超声法)
(3)LMV(large multilamellar vesicle):Reverse-phase evaporation(反向蒸发法)
(4)GMV(giant multilamellar vesicle):Sugar-doped lipid-film hydration(脂膜水化反法)
二、脂质体的质量控制
脂质体的质量指标包括颜色与形态、粒径及粒径分布、鉴别、包封率、释放度、溶血磷脂、有关物质和含量测定等,如为注射剂还应满足注射剂项下有关的注射剂通则要求。其中脂质体的粒径及粒径分布是其重要质量指标。
1.形态、粒径及其分布:
粒径是评价脂质体质量的关键指标之一,主动靶向脂质体的粒径及粒径分布只要满足注射剂要求即可;被动靶向脂质体的粒径及粒径分布能影响脂质体的吸收、体内分布、组织靶向性、稳定性、疗效及毒性。理想的脂质体是具有一定的粒径及分布范围较窄。
脂质体的粒径及粒径分布是脂质体质量的一项重要指标,粒径的大小直接影响脂质体药物的安全性、有效性以及药代动力学特性。同时,粒径也是区分纳米脂质体与普通脂质体的关键指标。现有文献报道的脂质体粒径及粒径分布的测定方法有光学显微镜法、扫描电镜法、透射电镜法、原子力显微镜法、计数法、光感应法(如粒径分布光度测定仪)和激光散射法(激光粒度测定仪)等。具体检测方法如下:
1.1光学显微镜法:
光学显微镜是利用光学原理,把人眼所不能分辨的微小物体放大成像,以供人们提取微细结构信息的光学仪器,根据其构造不同,分为生物显微镜,偏光显微镜和金相显微镜等。使用光学显微镜观察脂质体粒径及粒径分布的方法称为光学显微镜法。根据光波长的限制,光学显微镜只能观察粒径大于等于0.5μm的微粒。一般来讲,粒径大于等于2μm的脂质体可以用光学显微镜观察,但小于2μm的脂质体须用其他方法测定。测定的粒子数目应该具有统计学意义,一般需测定200~500个粒子。
1.2扫描电镜法:
扫描电镜是一种利用电子束扫描样品表面从而获得样品信息的电子显微镜,它能生成样品表面的高分辨率图像,且图像呈三维。扫描电镜通常被用来鉴定样品的表面结构。使用扫描电镜法测定脂质体粒径及粒径分布,需要对脂质体进行干燥和导电处理(金属镀膜法和组织导电法),测得的是处理后干燥的脂质体粒径。
1.3投射电镜法:
透射电镜是以波长极短的电子束作为照明源,用电磁透镜聚焦成像的一种高分辨本领、高放大倍数的电子显微镜。因为电子束穿透能力有限,要求样品做得很薄,一般要求在200nm左右。脂质体直接观察颜色很浅,很难分辨,一般采用磷钨酸负染法,加深脂质体的颜色,便于观察。通常负染色后脱水可观察脂质体,但样品的制备会导致脂质体融合或聚集,现可利用冷冻技术来克服该问题。
1.4原子力显微镜法:
原子力显微镜是一种利用原子、分子间的相互作用力来观察物体表面微观形貌的新型实验技术。原子力显微镜有一根纳米级探针,被固定在可灵敏操控的微米级弹性悬臂上,当探针很靠近样品时,其顶端的原子与样品表面原子间的作用力会使悬臂弯曲,偏离原来的位置,根据扫描样品时探针的偏离量或振动频率重建三维图像,就能间接获得样品表面的形貌或原子成分,从而以纳米级分辨率获得表面结构信息。
1.5计数法:
电感应计数法是在测定管中装入电解质溶液,将粒子群混悬在电解质溶液中,测定管壁上有一细孔,孔电极间有一定电压,当粒子通过细孔时,由于电阻发生改变使电流变化并记录于记录器上,最后将电信号换算成粒径的方法。本方法可用于测定脂质体的粒径及粒径分布;测定粒子的累积分布时,需要与高浓度电解质溶液混合,这会影响微粒的实际大小与形状。
光感应计数法是根据经过光感区域的粒子大小不同,光强随之产生相应的变化。将探测器收集的光信号转换成电压信号,不同的电压信号对应不同的粒径大小,从而得到微粒的粒径。单颗粒光学传感技术(SPOS)技术将光消减和光散射两种物理作用有机的结合起来,通过光消减获得较大的动态粒径范围,通过光散射增加对小粒子的灵敏度,成为一项专利技术。
光消减技术检测通过流动池的光强变化,拥有检测粒子的粒径范围广且与粒子组份无关等优点。然而,它的灵敏度有限,很难准确检测粒径小于1µm的粒子。另一方面,光散射技术具有相对窄的动态粒径范围,能检测到0.5µm粒径的粒子,使用大功率激光光源还能检测到粒径更小的粒子。通过合并光消减和光散射响应信号,传感器可同时拥有这两种方法的优点,因而在不损失单粒子分辨率巨大优势的前提下拥有相对较广的动态粒径范围 (即0.5~400 µm) 。
1.6激光散射法:
激光粒度法是指通过测定颗粒的衍射或散射光的空间分布(散射谱)来分析颗粒大小的方法,根据能谱稳定性分为静态光散射和动态光散射,相应的仪器为静态光散射粒度测定仪和动态光散射粒度测定仪(都是激光粒度测定仪),其中动态光散射测量范围大,可达0.3nm~10000nm。
1.6.1静态光散射法:
粒子处于静止状态,产生的散射光通过灵敏的光电检测器以特定散射角度进行测量,用来测量重均分子量Mw((分子量范围:104~107)、根均方旋转半径和第二维里系数A2。
1.6.2动态光散射法:
目前广泛应用于脂质体的粒径及粒径分布测定的是动态光散射技术, 又称准弹性光散射或光子相关光谱,其原理是粒子的布朗运动造成光散射波动随时间的信号变化,根据光信号和Stokes-Einstein方程的拟合结果, 得到样品的粒径及粒径分布。
动态光散射通过测量微粒的布朗运动并由此得出颗粒大小,通过Stokes-Einstein公式推算得到的是颗粒的水力学直径,即表面含水的水化粒子的表观直径(与在同样条件下有相同扩散系数的圆球相等价的直径),一般比颗粒的真实粒径偏大。
2.包封率和载药量
包封率:包封率=(脂质体中包封的药物/脂质体中药物总量)×100%
一般采用葡聚糖凝胶、超速离心法、透析法等分离方法将溶液中游离药物和脂质体分离,分别测定,计算包封率。通常要求脂质体的药物包封率达80%以上。
载药量:载药量=[脂质体中药物量/(脂质体中药物+载体总量)]×100%
载药量的大小直接影响到药物的临床应用剂量,故载药量愈大,愈易满足临床需要。载药量与药物的性质有关,通常亲脂性药物或亲水性药物较易制成脂质体。
3.脂质体的稳定性
(1)物理稳定性:主要用渗漏率表示。
渗漏率=(放置前介质中药物量-放置后介质中的药量)/制剂中药量x100%
胆固醇可以加固脂质双分子层膜,降低膜流动,可减小渗漏率。
(2)化学稳定性:
① 磷脂氧化指数:氧化指数=A233nm/A215nm;一般规定磷脂氧化指数应小于0.2。
② 磷脂量的测定:基于每个磷脂分子中仅含1个磷原子,采用化学法将样品中磷脂转变为无机磷后测定磷摩尔量(或重量),即可推出磷脂量。
4.防止氧化的措施
防止氧化的一般措施有充入氮气,添加抗氧剂-生育酚、金属络合剂等;也可直接采用氢化饱和磷脂。
5.脂质体的灭菌
灭菌的一般方法有过滤除菌、无菌操作、-射线照射(60钴15~20kGy)、121℃热压灭菌等。
三、脂质体粒径检测案例
采用MLV(multilamellar vesicle):Vortex-mixing(涡旋式混合)方式制备脂质体,对过滤挤出工艺前后样本脂质体用Nicomp 380设备进行粒度检测,测试结果如表2所示。
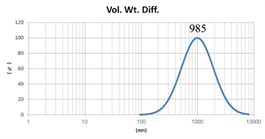
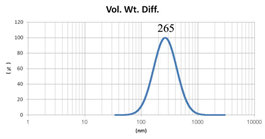
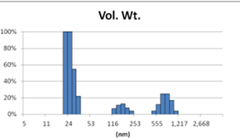
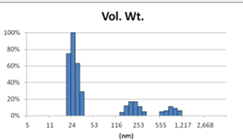
表2 MLV法制备脂质体过滤前后粒径分布图(Gaussian 分布)
Before Extrusion | After Extrusion through 0.4μm-pore-sized Filter (3 times) |
|
|
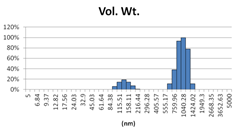
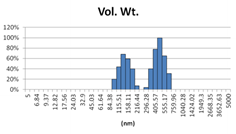
由表2可知,没有过滤挤出前Gaussian分布下平均体积径为985nm;经过0.4μm过滤器过滤挤出3次后,平均体积径为265nm;平均粒径明显降低。其Nicomp分布如表3所示。通过Nicomp分布可真实反映脂质体粒径分布情况,由表3中可知,未挤出脂质体体积粒径Nicomp分布有两个峰;一个峰粒径在130nm左右;一个峰在1μm左右;经过挤出及过滤之后,原本1μm处粒径明显降低,在500nm左右有峰。
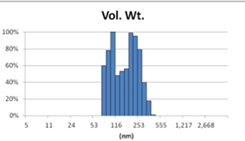
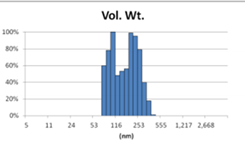
表3 MLV法制备脂质体过滤前后粒径分布图(Nicomp分布)
Before Extrusion | After Extrusion through 0.4μm-pore-sized Filter (3 times) |
|
|
对比Gaussian及Nicomp分布结果可知:Gaussian分布可整体反应脂质体粒径分布情况;而Nicomp分布更真实反映脂质体粒径分布。通过Nicomp数据的分析可以更好的帮助脂质体制备工艺的优化,选择合适的处理方式得到想要的粒径范围样本。
采用LMV(large multilamellar vesicle):Reverse-phase evaporation(反向蒸发法)制备脂质体,后续经过不同孔径过滤器过滤挤出工艺,其粒径分布测试结果如表4所示。
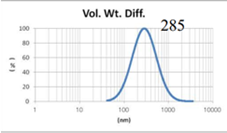
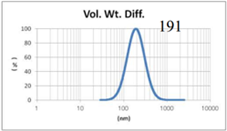
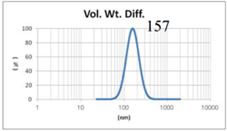
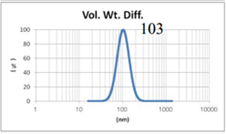
表4 LMV法制备脂质体过滤前后粒径分布图(Gaussian分布)
Before Extrusion | After Extrusion through 0.4μm Filter (3 times) |
|
|
After Extrusion through 0.2μm Filter (3 times) 0.2μm Filter (3 times) | After Extrusion through 0.1μm Filter (3 times) 0.2μm Filter (3 times) |
|
|
由表4可知,没有过滤挤出前LMV 制备脂质体Gaussian分布下平均体积径为285nm;经过0.4μm过滤器过滤挤出3次后,平均体积径变为191nm;后依次经过0.2μm和0.1μm过滤器过滤挤出平均体积粒径明显降低,分布为157nm和103nm。其Nicomp分布如表5所示。
表5 LMV法制备脂质体过滤前后粒径分布图(Nicomp分布)
Before Extrusion | After Extrusion through 0.4μm Filter (3 times) |
|
|
After Extrusion through 0.2μm Filter (3 times) 0.2μm Filter (3 times) | After Extrusion through 0.1μm Filter (3 times) 0.2μm Filter (3 times) |
|
|
由表5可知,未挤出脂质体体积粒径Nicomp分布有三个峰;经过0.4μm过滤器过滤之后,在Nicomp分布下仍然是3个峰;而经过0.2μm过滤器过滤后,Nicomp分布下呈现单峰,粒径大约在200nm左右;用0.10μm过滤器过滤后,Nicomp分布下呈现单峰,峰型较为对称,粒径大约在116nm。
由此可知,Nicomp分布可更真实反映样品粒径分布情况,当制备的脂质体样品均一性越佳时,其Gaussian分布结果与Nicomp分布结果越接近(如表4中右下图 Gaussian分布&表5中右下图 Nicomp分布)。
采用GMV(giant multilamellar vesicle):Sugar-doped lipid-film hydration(脂膜水化反法)方式制备脂质体,对不同次离心后样本脂质体用AccuSizer 780设备进行粒度检测,测试结果如表6所示。
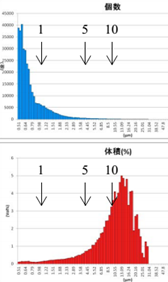
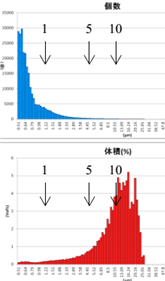
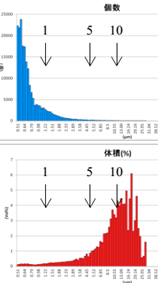
表6 GMV法制备脂质体离心后粒径分布图
After 1-time Centrifugation | After 2-time Centrifugation | After 3-time Centrifugation |
 |
|
|
由表6可知,上面蓝色谱图为数量粒径分布结果,下面红色谱图为体积粒径分布测试结果。分布对制备的脂质体样品进行1~3次离心处理,其数量粒径分布差异不大;观察体积粒径分布,可知:经过1次离心后,主体体积粒径分布在16μm左右;经过2次离心处理后,主体体积粒径在15μm左右;经过3次离心处理后,主体体积粒径在14μm左右。
通过AccuSizer 780设备数量粒径及体积粒径分布,可更详细真实反映脂质体样品粒度信息。
四、粒度检测解决方案
美国PSS可以提供脂质体粒度检测问题的最优化方案,对于纳米级别及纳微米级别样品可通过Nicomp 380设备进行测试,Nicomp分布可更真实反映脂质体样品信息;对于微米级别样品可通过AccuSizer 780设备进行测试,AccuSizer可进行颗粒技术,更详细真实反映脂质体样品信息。
测试纳米级别及亚微米级别样本粒径分布的仪器型号有:
Nicomp 380 N3000 和 Z3000
测试微米级别样本粒径分布的仪器型号有:
AccuSizer 780 A7000 AD
AccuSizer 780 A7000 APS