1. 引言
脂质体是制药工业中常规使用的双层囊泡,通常用于医药中靶向药物的研发。脂质体由磷脂组成,磷脂的极性末端连接到非极性链上,自组装成双层囊泡,极性末端面向水介质,非极性末端形成双层。在医药行业应用中脂质体经常在原料药中使用。如果API属于亲水性,那么将进入亲水基团内部,如果不是,将进入疏水基团夹层内,如图1所示。
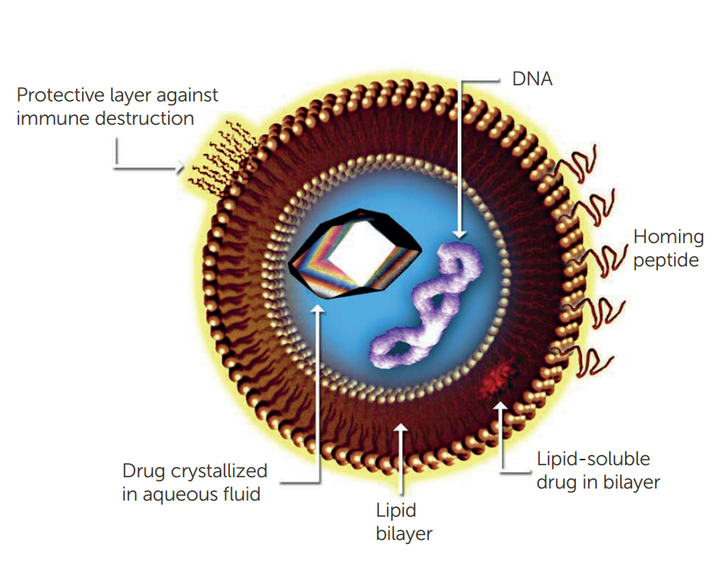
图 1. 用于药物输送的脂质体
获批的使用脂质体递送的药物之一Doxil,是一种阿霉素的重新配制版本。阿霉素药物位于聚乙二醇 (PEG) 涂层脂质体的亲水袋中。PEG涂层有助于逃避免疫系统的检测和破坏,提高稳定性并延长循环半衰期。脂质体的其他应用包括生物技术(siRNA 递送、抗体递送)和美容(乳液和面霜等)等领域。
脂质体可以根据它们的层状结构(单一的多层囊泡)、大小(小的、大的或巨型的)和制备方法进行分类。脂质体的主要类型是小单层囊泡(SUV)、小多层囊泡(SMV)、多层囊泡(MLV)、大单层囊泡(LUV)和巨型多层囊泡(GMV)。
脂质体的大小和载入脂质体的药物量在药物的药代动力学和药效学参数中起着关键作用。因此,准确快速地测量脂质体的大小对于新型有效的药物输送系统至关重要。

图 2. Nicomp N3000 DLS系统
大多数脂质体为亚微米(~20 – 250 nm),常见的粒径分析技术是动态光散射 (DLS),例如 Entegris Nicomp 系统,图 2。一些新型较大的 GMV 脂质体对于 DLS 分析来说太大(>5 µm ),并且可以使用 Entegris AccuSizer 单粒子光学尺寸 (SPOS) 系统进行测量,图 3。

图 3. 带有 SIS 采样器的 AccuSizer SPOS 系统
2. 加工过程中的尺寸测量
Nicomp 和 AccuSizer 都用于在制造过程中(例如通过滤膜挤出)精确测量脂质体的大小。 第一组结果,如图4至图6所示,显示了当脂质体通过减小尺寸的膜过滤器挤压时,Nicomp DLS系统的尺寸结果。
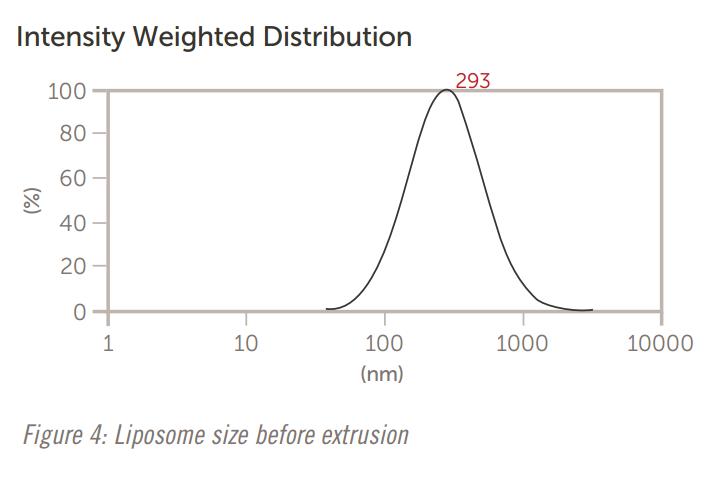
图4:挤出前的脂质体大小
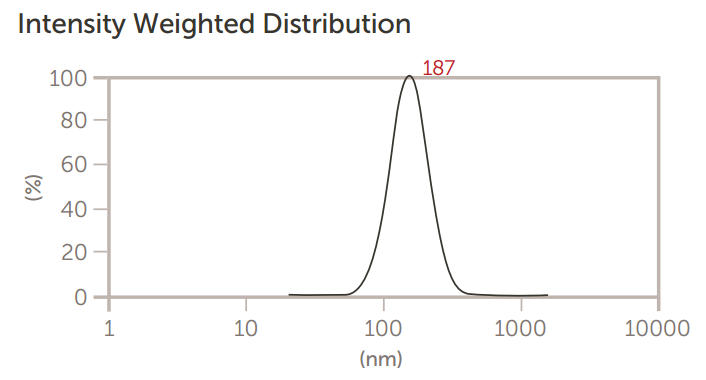
图5:脂质体通过0.4μm膜三次挤压后的大小
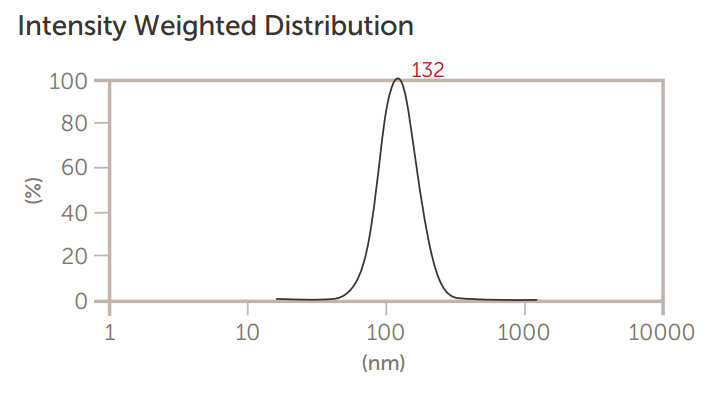
图6.脂质体通过0.1微米膜三次挤压后的尺寸
采用掺糖脂膜水化法制备了巨型多层囊泡(GMV)脂质体。然后,通过离心法和通过膜过滤器的挤压来减小尺寸。使用AccuSizer SPOS系统监测脂质体大小的变化,如图7至图10所示。
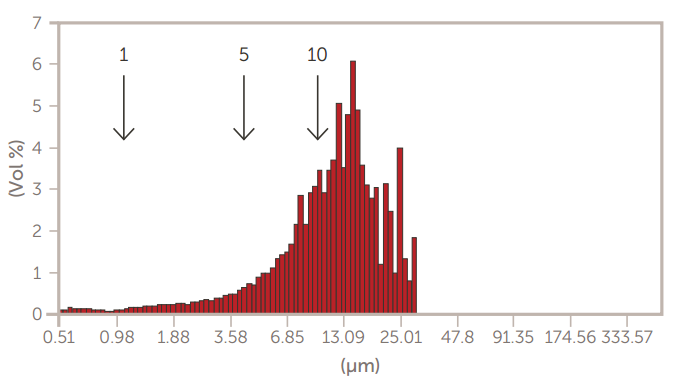
图7.离心前的GMV脂质体
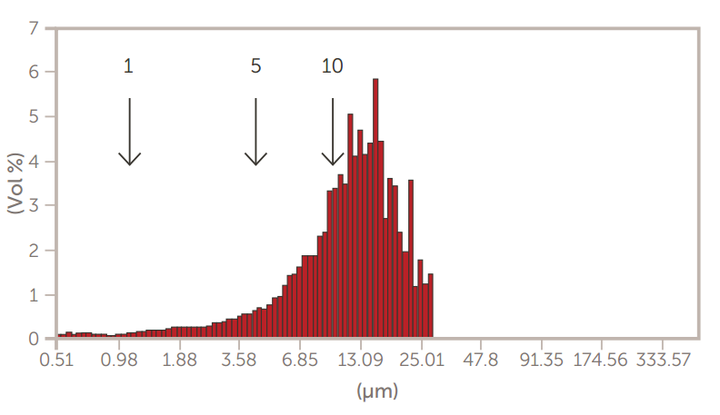
图8.离心后的GMV脂质体
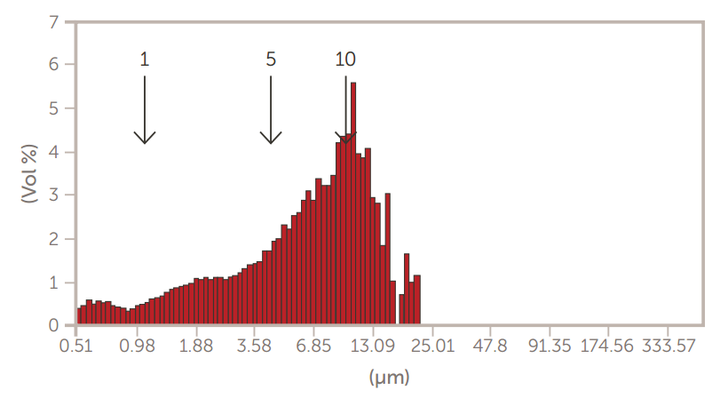
图9.通过5μm滤膜挤压后的GMV脂质体
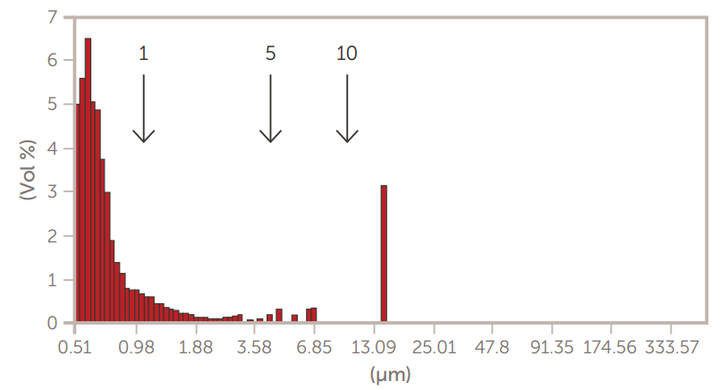
图10.通过10μm滤膜挤压后的GMV脂质体
3. 阳离子包衣脂质体
由阳离子脂质 DOTAP(N-[1-(2,3-二油酰氧基)丙基]-N,N,N-三甲基甲基硫酸铵)组成的脂质体已被证明是阴离子 RNA 和 DNA 核苷酸的有效载体。
阳离子脂质体提供的优势包括核苷酸的高包封效率和由于脂质双层上的整体阳离子静电荷而导致的高细胞摄取,为了防止血清诱导的聚集,阳离子脂质体已被聚乙二醇化以增加循环寿命,并允许在肿瘤组织。
在加州大学戴维斯分校创建和研究的阳离子脂质体包含用于封装微 RNA 的阳离子脂质 DOTAP。脂质体的大小至关重要,因为最终这些脂质体会被静脉注射到小鼠体内。因此,最终尺寸不应远大于 100 nm 左右。这些阳离子涂层脂质体的尺寸结果如图 11 所示。
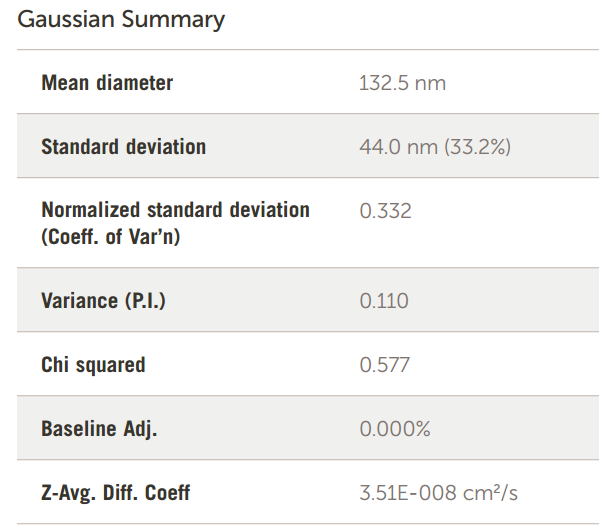
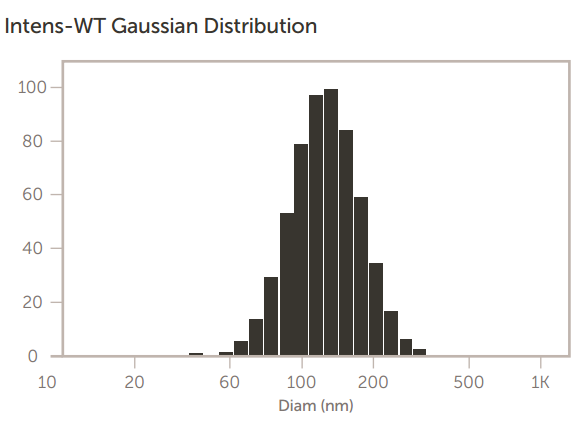
图 11. 阳离子涂层脂质体大小结果
4. 长循环脂质体
加州大学戴维斯分校 Ferrara 实验室研究的另一种脂质体用 Cu 标记,用作纳米示踪剂,通过正电子发射断层扫描 (PET) 改善头颈部肿瘤的可视化。 这种脂质体是一种特殊配方,是 HSPC / 的标准化组合cholesterol/DSPE-PEG2K,它创造了一种高度稳定、长循环的脂质体 (LCL),适用于许多不同的应用。在此配方中,使用摩尔比为 55.5:39:5.0 mol/mol/mol 的 HSPC/胆固醇/DSPE-PEG2K,然后用 6-BAT-PEG-脂质功能化以进行 Cu 放射性标记。Cu 脂质体在各种癌症中积累,提供敏感的示踪剂和纳米治疗药物生物分布的指示。
Cu LCL脂质体的大小如图12所示。
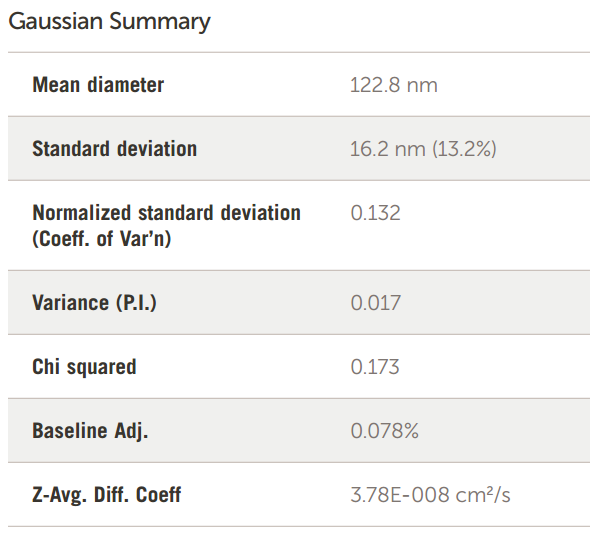
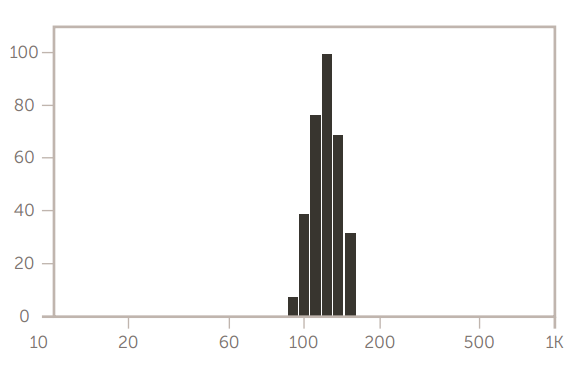
图 12. Cu 标记的 LCL 脂质体大小结果
5. 热敏脂质体
此外,热敏脂质体已被制备,以提高热诱导释放这些粒子的内容物在特定的目标位点。在一项研究中, 在含有热敏脂质体(LTSLs)的裂解脂质核心中,阿霉素(Dox)和铜(CuDox)之间形成了pH敏感复合物。这些脂质体由DPPC:DSPE-PEG2k:MPPC(86:4:10,摩尔比)组 成,其中DPPC为1,2-二脂酰基-sn-甘油-3-磷酸胆碱,DSPE-PEG2k为1,2distearoyl-snglycero-3- phosphoethanolamine-N-Methoxy聚乙二醇-2000,MPPC为 1-棕榈酰基-2-羟基-sn-甘油-3-磷酸胆碱。将铜TEA脂质 体(铜(II)葡萄糖酸铜、三甘氨酸胺(TEA)与非包封铜TEA 分离,诱导脂质体膜上的盐梯度。MPPC-Copper TEA脂质体的大小如图13所示。
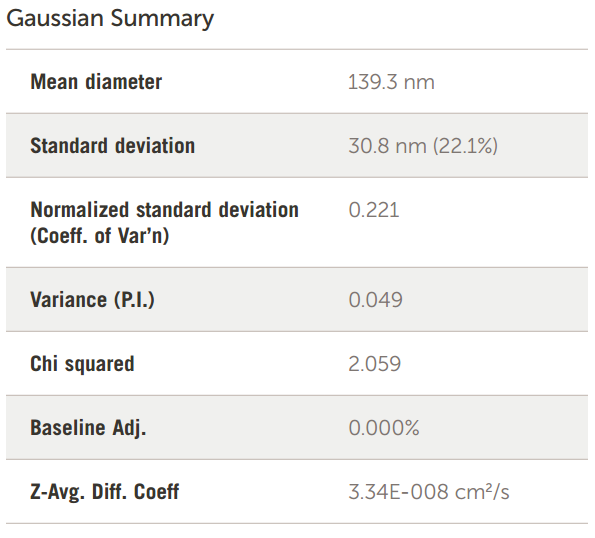
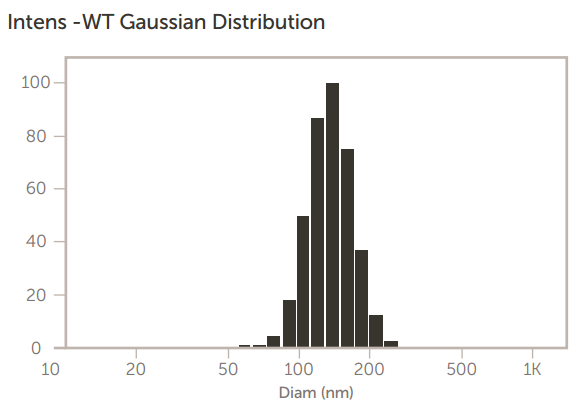
图 13. MPPC-铜 TEA 脂质体
一旦这些脂质体的制备和大小被验证,它们就会通过TEA负载治疗药物阿霉素——阿霉素在TEA出来的时候进入脂质体。
6 ZR-89 标记脂质体的 ZETA 电位
在另一项研究中,创建了 Zr-89 标记的脂质体,以评估长循环脂质体在一周内的药代动力学。放射性被隔离在亲水性内腔、脂质双层或脂质体表面。本研究中的脂质体在 Nicomp DLS 系统上测量了大小分布,值范围为 114-120 nm。
还使用相位分析光散射模式 (PALS) 和浸池在 Nicomp 上测量了 zeta 电位。测量设置包括在电极之间 0.4 厘米的间隙上施加 12 V/cm 的电场,并使用 Smoluchowski 极限。多次测量的结果如图 14 所示。
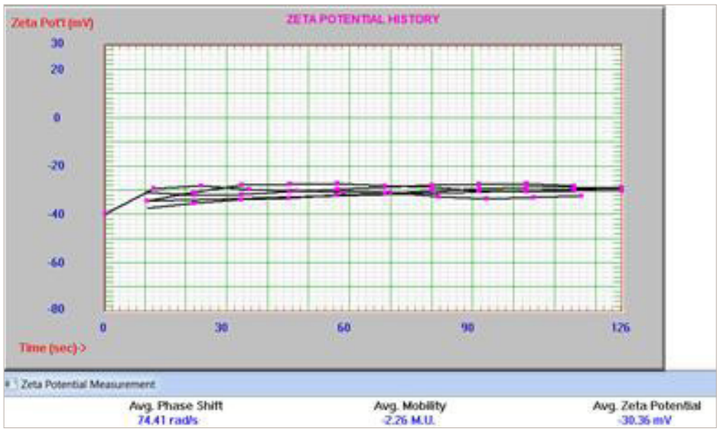
图 14. NH2-Peg2K 脂质体的 Zeta 电位结果
参考资料
[1] Aoki, N. & Hashimoto, M., Hashimoto Electronic Industry CO. and Yoshimura, T. Liposome Engineering Laboratory, Measurement of Liposome Size Distribution Using Nicomp 380 and AccuSizer 780 AD, presentation, July 2013
[2] Thanks to Elizabeth Ingham, Azadeh Kheirolomoom and Jai Seo from the Dr. Katherine Ferrara Lab in the Department of Biomedical Engineering at UC Davis for sharing these data and helping to create this document
[3] Mahakian, L. et.al., Comparison of PET Imaging with 64Cu-Lipsomes and 18F-FDG in the 7,12-Dimethylbenz[a] anthracene (DMBA)-Induced Hamster Buccal Pouch Model of Oral Dysplasia and Squamous Cell Carcinoma, Mol Imaging Biol (2013)
[4] Kheirolomoom, A. et.al., Complete regression of local cancer using temperature-sensitive liposomes combined with ultrasound-mediated hyperthermia, Journal of Controlled Release, 172 (2013)
[5] Seo, J. et.al., The pharmacokinetics of Zr-89 labeled liposomes over extended periods in a murine tumor model, Nuclear Medicine and Biology 42 (2015)
|
|











